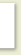Если обозначить молярную концентрацию электролита через c, а
степень ионизации через , то концентрация каждого из ионов будет
равна с • , а концентрация неионизированных молекул будет равна
с—с, или с • (1—). Подставив полученные значения в уравнение константы ионизации бинарного электролита, получим:
В такой форме полученное уравнение выражает закон разбавления, выведенный В. Оствальдом. Он устанавливает зависимость между
степенью ионизации слабого электролита и его концентрацией. Если
электролит является достаточно слабым и раствор его не слишком разбавлен, то степень ионизации его () мала и величина (1 - ) мало отличается от 1. Следовательно, можно принять, что
Закон разбавления позволяет вычислять степень ионизации, если
известна константа ионизации и молярная концентрация раствора электролита, и, наоборот, определив тем или иным методом степень ионизации, можно вычислить константу ионизации по уравнению:
Ознакомимся с методикой вычисления константы и степени ионизации на основе использования закона разбавления.
Пример 1. Вычислить константу ионизации уксусной кислоты, если степень ионизации 0,1 н. раствора ее равна 1,35%.
Решение.
Для вычисления константы ионизации уксусной кислоты необходимо перейти от величины степени ионизации, выраженной в процентах, к ее величине, выраженной в молях. Уксусная кислота одноосновная, следовательно, 0,1 н. раствор ее является 0,1 М. Отсюда:
1 моль составляет 100%
x моль составляет 1,35% x = 1,35 • 1/ 100 = 0,0135 (моль/л)
или a = 1,35/ 100 = 0,0135 (моль/л).
По закону разбавления получим: K =1 0,0135
0,1 0,01352
• = 1, 85 • 10 -5
Обе найденные величины констант ионизации уксусной кислоты
очень хорошо согласуются между собой. Следовательно, ионизация уксусной кислоты — типичного слабого электролита — подчиняется закону действия масс и вполне согласуется с теорией электролитической
диссоциации.
|