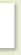Активность
для бесконечно разбавленных растворов равна молярной концентрации
вещества: а = с и выражается в грамм ионах на литр.
Для реальных растворов вследствие сильного проявления межионных сил активность меньше молярной концентрации иона. Поэтому
активность можно рассматривать как величину, характеризующую степень связанности частиц электролита. С понятием «активность» связано
и другое понятие – “коэффициент активности” (f), который характеризует степень отклонения свойств реальных растворов от свойств идеальных растворов; он является величиной, отражающей все происходящие в растворе явления, вызывающие понижение подвижности ионов и
снижающие их химическую активность. Численно коэффициент активности равняется отношению активности к общей молярной концентрации иона:
f = ac
а активность равна молярной концентрации, умноженной на коэффициент активности: а = cf
Для сильных электролитов молярную концентрацию ионов (с) вычисляют, исходя из допущения полной диссоциации их в растворе. Физико-химики различают активную и аналитическую концентрацию ионов в растворе. Активной концентрацией называется концентрация свободных гидратированных ионов в растворе, а аналитической концентрацией — общая молярная концентрация ионов, определяемая, например, путем титрования.
Коэффициент активности ионов зависит не только от концентрации ионов данного электролита, но и от концентрации всех посторонних ионов, присутствующих в растворе. Величина коэффициента активности понижается с возрастанием ионной силы раствора.
2 8
Ионной силой раствора (,) называется величина электрического
поля в растворе, являющаяся мерой электростатического взаимодействия между всеми ионами в растворе. Она вычисляется по формуле,
предложенной Г. Н. Льюисом и М. Ренделом в 1921 г.:
=
2
1 (c1 Z2
1 + c2 Z2
2 + ...... + cn Z2
n)
где c1, c2 и cn — молярные концентрации отдельных ионов, присутствующие в растворе, a Z2
1, Z2
2 и Z2
n — их заряды, взятые в квадрате. Недиссоциированные молекулы, как не имеющие зарядов, в формулу подсчета ионной силы раствора не включаются.
Таким обраэом, ионная сила раствора равна полусумме произведений концентраций ионов на квадраты их зарядов, что можно выразить
уравнением: μ = c
2
1 i • Z i 2
|